第三轮国家集采,规则或变?
第三批国家药品集采,今日迎来最新进展
1
第三轮国家药品集采召开讨论会
据业内人士消息,6月24日上午,上海药事所召开第三批国家药品集中采购企业座谈会,12家药企出席会议——包括默沙东、诺华、安斯泰来、优时比四家外企;齐鲁、扬子江、石药、上药、华海、石药等八家国内知名企业。
按照此前惯例,此次会议的主要目的仍然是调查和收集企业针对相关问题的意见——主要涉及采购周期与中选企业数量、药品供应、差比价、抗生素占比、串标5个问题。
近日,宁夏、湖北等省分别下发文件,要求当地医疗机构填报第三批国采药品采购数据。
根据宁夏医保局的通知,7月10日是自治区医保局将全区采购数据上报至国家联采办的最后截止日期。湖北省要求各地市医保部门须于7月3日下午5点前完成本辖区医疗机构报量数据的审核和上报工作。
按照以往一年轮替两批次带量采购的节奏,第三轮国采的报价工作可能于7月底前后开展。
回归此前的国家集采,首轮4+7集采2018年12月出结果,次年2-3月陆续落地;6个月后,首批25个品种的采购扩围至全国;第二轮集采,2020年1月结果出炉,目前已经进入采购阶段。
2
聚焦中选企业数量等五大问题
采购周期与中选企业数量
采购周期与中选企业数量的问题在此前的两批集采中,一直在调整和优化,此次座谈会医保局再次就这一问题征询企业意见。
首轮4+7集采:11个试点城市,25个品种,12个月的采购周期,只允许最低价企业一家中选。
4+7扩围:覆盖25个联盟地区,最多允许3家企业中选共享约定采购量的70%(1家50%、2家60%),采购周期最长为2年(视情况可延长一年,即共3年)。
第二轮集采:全国参与,32个品种,最多允许6家企业中选,4家及以上企业中选的品种采购周期为3年(1家1年,2家或3家2年),4家及以上中选的共享约定采购量的80%(1家中选50%,2家中选60%,3家中选70%)。
在首轮集采中,就采购周期问题,企业的主要意见是一年的采购周期过短,企业的产能调整存在困难;在第二轮集采中,针对部分企业品种的采购周期被延长至3年,又出现了企业无法续约供应的情况;第三轮集采的采购周期将如何调整值得关注。
中选企业数量可以说是药企最为关注的问题。从4+7的独家中标,到4+7扩围的最多3家中标,再到第二轮集采的最多6家中标,从中选企业数量的角度看,药企的中标压力有所缓和,但是从价格降幅的角度看,似乎增加中选企业并没有降低企业大幅降价的心理压力,企业之间存在零和博弈的倾向。如何实现中选企业数量与企业竞争压力的平衡,也是一个存在变数的问题。
毕竟在第三轮集采中,部分品种如二甲双胍符合投标资格的企业达到20多家,是否仍然按照最多6家药企中选尚未可知。
差比价问题
就中选价问题,此前国家医保局在关于政协十三届全国委员会第二次会议第0322号(医疗体育类027号)提案答复的函中回应到,试点会在质量一致性的前提下,继续采用“最低价中标”,不会设置“中位价”中标。
也就是说,在全国药品集采中,最低价中标这一大的原则大概率不会改变,有优化空间的主要是具体的细则。
第二轮集采方案确定拟中选药企的准则如下——入围企业价格符合以下条件之一的,获得拟中选资格:
12.1“单位可比价”≤同品种最低“单位可比价”的 1.8 倍。
12.2“单位申报价”降幅≥50.00%(以《采购品种目录》对应规格最高有效申报价为基数进行计算)。降幅以百分比计,四舍五入保留百分比小数点后 2 位。
12.3“单位可比价”≤0.1000 元。
单位可比价离不开差比价规则——集采方案要求企业申报价,以采购品种目录中同品种最小规格作为代表规格,按药品差比价规则折算至单片/单袋/单支等后的价格作为“单位可比价”。
所谓差比价规则是指,同种药品不同剂型规格,应当以代表品价格为基础,按照规定的药品差比价关系制定价格,最终用于比价的数额还要乘以一定的系数。
在此前的两轮集采中,均有药企因为不熟悉差比价等规则导致未中标、流标,此次相关部门把这个问题拿出来讨论可能也是为了进一步优化明晰相应规则,提高企业报价的针对性。
药品供应问题
伴随着第二轮药品集采的落地,此前上海、云南等省市曾发布通知,点名部分药企的集采品种存在供应异常的问题,虽然相关文件再三强调中选药企要保证供应,但是供应紧张的问题仍然部分出现。
就此,有专业人士对赛柏蓝表示,药企的中选品种供应紧张原因是多方面的,从企业端的角度看,部分药企由于原料药、产能调节问题影响了产品供应;从医院端来看,早期,医院报量普遍保守,但是在要求保障中选药品使用量和医院超额采购药企仍要按中选价供应等政策的推动下,医院的采购量普遍较大,也导致企业难以及时跟进供应。
有数据显示,截至2019年底,首轮带量采购试点地区平均采购执行进度为183%,大幅超出约定采购量,中选品种占通用名药品采购量的78%。
抗生素品种占比问题
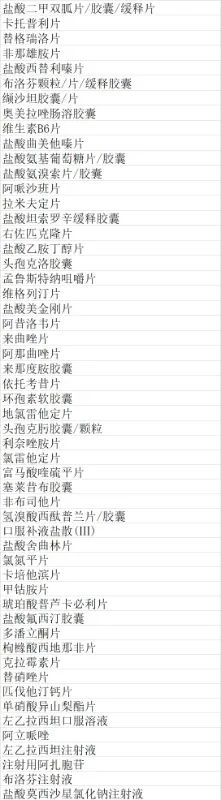
第三轮国家药品集采覆盖阿莫西林、盐酸莫西沙星氯化钠、头孢克洛、环丙沙星等销量较大的抗生素品种,但是相关部门也在考虑在限抗的大背景下,纳入这些品种是否合适的问题。
从这一问题的讨论可以延伸出一个值得注意的话题那就是集采品种的边界问题,国家集采的品种选择除受一致性评价进展情况限制,还需要考虑药品的临床用量、市场的竞争情况、企业的产能供应等。
针对辅助用药、抗生素等品种,如果临床的管理要求是合理用、少用,那就和纳入集采后保证使用的原则有所违背,这似乎也透露出有部分品种将从国家集采中豁免。
其实,除抗生素占比问题外,还有一点值得关注,那就是剂型问题。第三轮国家集采纳入了注射用阿扎胞苷、左乙拉西坦、莫西沙星氯化钠3个注射剂型,从品种数量上来说,占比很小。
回顾仿制药一致性评价的工作进展,5月14日,国家药监局正式发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,宣布化学药品注射剂仿制药,正式开展一致性评价工作。
从这一点可以看到,虽然部分省市针对注射剂集采已经开始有所动作,但是国家层面的集采仍然是和一致性评价的官方进度高度相关的。可以说,预测可能进入集采的品种就必须关注相关部门针对一致性评价的工作安排以及药企开展相关品种一致性评价的工作进度。
不出预料的话,随着更多的注射剂通过一致性评价,针对注射剂的带量采购也会进一步推进。
除上述四个问题外,会议还讨论了集采中的串标问题。随着相关规则的明晰,不日,第三轮集采就将正式进入药企报量阶段。